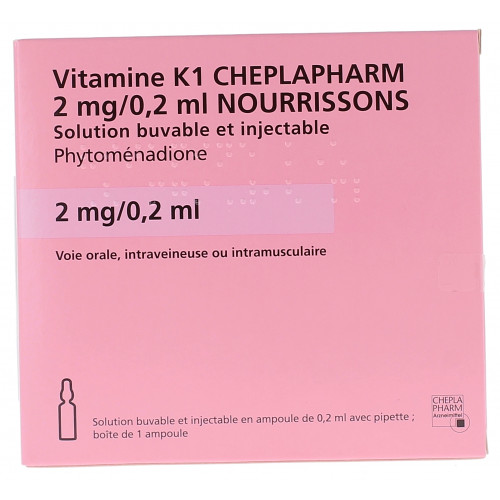


VITAMINE K1 CHEPLAPHARM 2 mg/0,2 ml NOURRISSONS, solution buvable et injectable est un médicament qui appartient à la famille des antihémorragiques.
La substance active est la vitamine K1 (également appelée phytoménadione), une protéine naturellement présente dans l'organisme. La vitamine K1 est indispensable à la synthèse par le foie de plusieurs facteurs de la coagulation sanguine, ce qui permet d'assurer une coagulation du sang normale et d'empêcher les saignements trop longs.
Ce médicament est utilisé pour compenser le manque en vitamine K1 et ainsi prévenir et traiter les saignements (hémorrag...
Fiche technique
Références spécifiques
Attention ceci est un médicament
Pour connaître les précautions d’emploi ainsi que la posologie, veuillez consulter la notice du médicament. Si vos symptômes persistent, consultez votre médecin.
Ceci est un médicament.
Dans l'intérêt du patient, la vente en ligne de médicaments est strictement réglementée en France.
Notre site est adossé à la Pharmacie Française Citypharma (Paris 6) et agréé par l’Agence Régionale de Santé d’Île de France depuis le 1er juillet 2014.
Voie orale ou injectable (I.V. ou I.M.) suivant les indications.
Prévention de la maladie hémorragique du nouveau-né :
Nouveau-nés en bonne santé de 36 semaines de gestation et plus :
· Soit 1 mg administré par injection intramusculaire à la naissance ou peu après ;
· Soit :
o 2 mg per os à la naissance ou peu après,
o puis une deuxième dose de 2 mg per os administrée entre le 4ème et le 7ème jour,
o puis une dose supplémentaire de 2 mg per os administrée 1 mois après la naissance.
Pour les nouveau-nés allaités exclusivement au lait artificiel, la troisième dose orale peut être omise.
Chez les enfants en allaitement maternel exclusif, il a été conseillé des doses orales supplémentaires, mais les données de tolérance et d'efficacité pour ces doses supplémentaires sont limitées (voir rubrique 5.1).
Nouveau-nés prématurés de moins de 36 semaines de gestation pesant 2,5 kg ou plus, nouveau-nés à terme mais à risque (prématurité, asphyxie à la naissance, ictère rétentionnel, incapacité à avaler, utilisation d'anticoagulants ou d'antiépileptiques chez les mères):
· 1 mg par voie IM ou IV à la naissance ou peu après.
La quantité et la fréquence des doses ultérieures sont déterminées en fonction des paramètres de la coagulation. La vitamine K1 peut être administrée sans aucune dilution pour les nouveau-nés de 2,5 kg ou plus (voir Tableau 1)
Nouveau-nés prématurés de moins de 36 semaines de gestation pesant moins de 2,5 kg :
· 0,4 mg/kg (équivalent à 0,04 ml/kg) administrée par voie IM ou IV à la naissance ou peu après. Cette dose parentérale ne doit pas être dépassée.
La quantité et la fréquence des doses ultérieures sont déterminées en fonction des paramètres de la coagulation.
IL A ETE MONTRE QUE LA PROPHYLAXIE PAR VOIE ORALE EST INSUFFISANTE CHEZ LES PATIENTS PRESENTANT UNE MALADIE HEPATIQUE CHOLESTASIQUE SOUS-JACENTE ET UNE MALABSORPTION (voir rubrique 5.1).
AVERTISSEMENT : une attention est nécessaire en calculant et en mesurant la dose en fonction du poids du nouveau-né (des erreurs de posologie de l'ordre de 10 fois la dose sont fréquentes).
Informations sur les doses dans la prophylaxie de la maladie hémorragique du nouveau-né prématuré :
Pour garantir une utilisation en toute sécurité chez le nouveau-né de moins de 2,5 kg, et notamment permettre l'utilisation de volumes faciles à manipuler pour l'injection, il est conseillé d'administrer la vitamine K1 diluée à 1/5 OU à 1/10 dans du glucose 5% selon les facilités d'administration (voir Tableau 1).
Pour l'administration intramusculaire, la limite habituelle du volume d'injection doit être prise en compte.
La compatibilité de la solution de vitamine K1 à 2 mg / 0,2 ml a été démontrée avec une solution de glucose 5% et ce, aux dilutions de 1/5 et de 1/10.
Tableau 1 Posologie pour les nouveau-nés prématurés :
|
Poids du nouveau-né |
Dose de vitamine K1 à la naissance |
Volume injectable sans dilution |
Volume injectable avec dilution au 1/5 Vitamine K1 (2mg/0,2ml) 0,2 mL + Glucose 5% 0,8 mL |
Volume injectable avec dilution au 1/10 Vitamine K1 (2mg/0,2ml) 0,2 mL+ Glucose 5% 1,8 mL |
|
1 kg |
0,4 mg |
0,04 ml |
0,2 ml |
0,4 ml |
|
1,25 kg |
0,5 mg |
0,05 ml |
0,25 ml |
0,5 ml |
|
1,5 kg |
0,6 mg |
0,06 ml |
0,3 ml |
0,6 ml |
|
1,75 kg |
0,7 mg |
0,07 ml |
0,35 ml |
0,7 ml |
|
2 kg |
0,8 mg |
0,08 ml |
0,4 ml |
0,8 ml |
|
2,25 kg |
0,9 mg |
0,09 ml |
0,45 ml |
0,9 ml |
|
|
|
|
|
|
|
≥2,5 kg |
1 mg |
0,1 ml |
Ne pas diluer |
Ne pas diluer |
Traitement de la maladie hémorragique du nouveau-né :
· Dose initiale de 1 mg par voie IM ou IV lente.
La quantité et la fréquence des doses ultérieures sont déterminées en fonction des paramètres de la coagulation.
ANSM - Mis à jour le : 01/08/2019
VITAMINE K1 CHEPLAPHARM 2 mg/0,2 ml NOURRISSONS, solution buvable et injectable.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Phytoménadione............................................................................................................................ 2,00 mg
Pour une ampoule de 0,2 ml
Excipient à effet notoire
Pour la liste complète des excipients, voir rubrique 6.1.
Solution buvable et injectable.
4.1. Indications thérapeutiques 
Traitement et prophylaxie de la maladie hémorragique du nouveau-né.
4.2. Posologie et mode d'administration 
Voie orale ou injectable (I.V. ou I.M.) suivant les indications.
Prévention de la maladie hémorragique du nouveau-né :
Nouveau-nés en bonne santé de 36 semaines de gestation et plus :
· Soit 1 mg administré par injection intramusculaire à la naissance ou peu après ;
· Soit :
o 2 mg per os à la naissance ou peu après,
o puis une deuxième dose de 2 mg per os administrée entre le 4ème et le 7ème jour,
o puis une dose supplémentaire de 2 mg per os administrée 1 mois après la naissance.
Pour les nouveau-nés allaités exclusivement au lait artificiel, la troisième dose orale peut être omise.
Chez les enfants en allaitement maternel exclusif, il a été conseillé des doses orales supplémentaires, mais les données de tolérance et d'efficacité pour ces doses supplémentaires sont limitées (voir rubrique 5.1).
Nouveau-nés prématurés de moins de 36 semaines de gestation pesant 2,5 kg ou plus, nouveau-nés à terme mais à risque (prématurité, asphyxie à la naissance, ictère rétentionnel, incapacité à avaler, utilisation d'anticoagulants ou d'antiépileptiques chez les mères):
· 1 mg par voie IM ou IV à la naissance ou peu après.
La quantité et la fréquence des doses ultérieures sont déterminées en fonction des paramètres de la coagulation. La vitamine K1 peut être administrée sans aucune dilution pour les nouveau-nés de 2,5 kg ou plus (voir Tableau 1)
Nouveau-nés prématurés de moins de 36 semaines de gestation pesant moins de 2,5 kg :
· 0,4 mg/kg (équivalent à 0,04 ml/kg) administrée par voie IM ou IV à la naissance ou peu après. Cette dose parentérale ne doit pas être dépassée.
La quantité et la fréquence des doses ultérieures sont déterminées en fonction des paramètres de la coagulation.
IL A ETE MONTRE QUE LA PROPHYLAXIE PAR VOIE ORALE EST INSUFFISANTE CHEZ LES PATIENTS PRESENTANT UNE MALADIE HEPATIQUE CHOLESTASIQUE SOUS-JACENTE ET UNE MALABSORPTION (voir rubrique 5.1).
AVERTISSEMENT : une attention est nécessaire en calculant et en mesurant la dose en fonction du poids du nouveau-né (des erreurs de posologie de l'ordre de 10 fois la dose sont fréquentes).
Informations sur les doses dans la prophylaxie de la maladie hémorragique du nouveau-né prématuré :
Pour garantir une utilisation en toute sécurité chez le nouveau-né de moins de 2,5 kg, et notamment permettre l'utilisation de volumes faciles à manipuler pour l'injection, il est conseillé d'administrer la vitamine K1 diluée à 1/5 OU à 1/10 dans du glucose 5% selon les facilités d'administration (voir Tableau 1).
Pour l'administration intramusculaire, la limite habituelle du volume d'injection doit être prise en compte.
La compatibilité de la solution de vitamine K1 à 2 mg / 0,2 ml a été démontrée avec une solution de glucose 5% et ce, aux dilutions de 1/5 et de 1/10.
Tableau 1 Posologie pour les nouveau-nés prématurés :
|
Poids du nouveau-né |
Dose de vitamine K1 à la naissance |
Volume injectable sans dilution |
Volume injectable avec dilution au 1/5 Vitamine K1 (2mg/0,2ml) 0,2 mL + Glucose 5% 0,8 mL |
Volume injectable avec dilution au 1/10 Vitamine K1 (2mg/0,2ml) 0,2 mL+ Glucose 5% 1,8 mL |
|
1 kg |
0,4 mg |
0,04 ml |
0,2 ml |
0,4 ml |
|
1,25 kg |
0,5 mg |
0,05 ml |
0,25 ml |
0,5 ml |
|
1,5 kg |
0,6 mg |
0,06 ml |
0,3 ml |
0,6 ml |
|
1,75 kg |
0,7 mg |
0,07 ml |
0,35 ml |
0,7 ml |
|
2 kg |
0,8 mg |
0,08 ml |
0,4 ml |
0,8 ml |
|
2,25 kg |
0,9 mg |
0,09 ml |
0,45 ml |
0,9 ml |
|
|
|
|
|
|
|
≥2,5 kg |
1 mg |
0,1 ml |
Ne pas diluer |
Ne pas diluer |
Traitement de la maladie hémorragique du nouveau-né :
· Dose initiale de 1 mg par voie IM ou IV lente.
La quantité et la fréquence des doses ultérieures sont déterminées en fonction des paramètres de la coagulation.
4.4. Mises en garde spéciales et précautions d'emploi 
Chez le nouveau-né à risque hémorragique majoré (prématuré, pathologie néonatale, ictère important, traitement par inducteur enzymatique de la mère ), l'apport doit se faire par voie I.M. ou I.V. lente. S'il y a nécessité de répéter les doses, en particulier chez le prématuré, la voie d'administration sera reconsidérée pour chaque dose en fonction de l'état clinique du nouveau-né.
Chez les nouveau-nés ou les nourrissons ayant une pathologie digestive ou hépatique, une malabsorption digestive, et dans toutes les situations autres où l'absorption de la vitamine K1 peut être insuffisante ou son métabolisme accéléré (notamment en cas de traitement par inducteurs enzymatiques), la posologie devra être adaptée, ou il sera préférable d'utiliser la voie I.M. ou I.V. lente.
Pour les nouveau-nés non alimentables ou régurgitants, il est préférable d'utiliser la voie injectable.
Chez les sujets porteurs d'un déficit enzymatique en G6PD, de très rares cas d'hémolyse aigüe ont été rapportés lors de l'administration de phytoménadione. Il est donc important de prendre en compte pour chaque patient, le danger d'hémolyse et de bénéfice potentiel attendu du traitement.
Précautions d'emploi
L'administration orale impose une surveillance particulière de l'absence de régurgitation au moment ou dans les heures suivant la prise, ainsi que l'assurance d'une bonne compliance. En cas de régurgitation, une dose supplémentaire doit être administrée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
La vitamine K1 antagonise les effets des anti-coagulants de type coumariniques.
4.6. Fertilité, grossesse et allaitement 
Cette forme pharmaceutique est réservée au nourrisson.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
· Par voie intraveineuse: possibilité de réaction allergique ;
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Il n'existe pas de syndrome clinique connu attribuable à un surdosage en vitamine K1.
Les évènements indésirables suivants ont été rapportés lors de surdosage en Vitamine K1 chez des nouveau-nés et des nourrissons : ictère, hyperbilirubinémie, augmentation des transaminases et des gamma-GT, douleur abdominale, constipation, selles molles, malaise, agitation et éruption cutanée.
La relation de causalité avec le surdosage en vitamine K1 n'a pu être établie de façon formelle. La plupart de ces évènements indésirables étaient considérés comme non graves et se sont résolus spontanément.
En cas de suspicion de surdosage accompagné d'effet indésirable, le traitement doit être arrêté de façon définitive. Un traitement symptomatique peut être instauré si nécessaire.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
La vitamine K1 est un facteur indispensable à la synthèse hépatique de plusieurs facteurs de la coagulation (prothrombine, proconvertine, facteur antihémophilique B, facteur de Stuart, protéines C et S).
Si l'alimentation est équilibrée et le tube digestif fonctionnel, l'apport supplémentaire de la vitamine K1 est inutile.
En cas de carence (trouble de l'absorption ou de l'utilisation), le taux de ces facteurs diminue et un risque hémorragique devient possible.
L'effet de la vitamine K1 n'est pas immédiat, même lorsque celle-ci est administrée par voie veineuse.
Population pédiatrique
Une étude contrôlée randomisée prospective a inclus 44 nourrissons (âgés de 1 à 26 semaines) atteints d'hyperbilirubinémie conjuguée (17 patients atteints d'hépatite néonatale idiopathique, 13 patients atteints d'atrésie des voies biliaires, 3 patients atteints de cholestase en nutrition parentérale totale, 2 patients atteints de syndrome d'Alagille, 2 patients atteints de déficit en alpha-1-antitrypsine, 2 patients atteints de syndrome de bile épaisse, et 5 patients qui ont présenté divers diagnostics (fructosémie, galactosémie, kyste cholédocien, entérocolites nécrosantes, hépatite à cytomégalovirus). Chez ces nourrisons atteints de maladie cholestatique du foie, la pharmacocinétique et l'efficacité de la vitamine K1, solution micellaire mixte, par voie orale et par voie intraveineuse, en prophylaxie, ont été comparées.
Les principaux critères d'évaluation étaient la concentration sérique en vitamine K1 et en prothrombine sous-carboxylée (PIVKA-II), avant et jusqu'à 4 jours après administration d'une dose unique de 1 mg par voie intraveineuse ou 2 mg par voie orale de vitamine K1, solution micellaire mixte. Une comparaison des concentrations de vitamine K1, 24 heures après l'administration par voie orale a également été faite avec celles de 14 nouveau-nés sains ayant reçu la même dose.
Résultats : A l'admission, 18 nourrissons (41%) avaient présenté des concentrations sériques élevées en PIVKA-II et 8 (18%) ont présenté des concentrations basses en vitamine K1, signe d'un déficit en vitamine K subclinique. Initialement, les concentrations sériques médianes en vitamine K1 étaient similaires dans les groupes ayant reçu de la vitamine K1 par voie orale et ceux ayant reçu de la vitamine K1 par voie intraveineuse (0,92 vs 1,15 ng/ml), et ont augmenté au bout de 6 heures, à 139 ng/ml chez les patients traités par voie intraveineuse, mais seulement à 1,4 ng/ml chez ceux traités par voie orale.
Dans ce dernier groupe, la concentration sérique en vitamine K1 mesurée est basse (médiane 0.95 ng/ml, intervalle de confiance large <0,15-111 ng/ml) par rapport aux niveaux, beaucoup plus élevés, observés chez les nourrissons sains ayant reçu la même dose par voie orale (médiane 77, intervalle de confiance 11-263 ng/ml), suggérant une absorption diminuée et irrégulière chez les nourrissons cholestatiques. La sévérité de la malabsorption était telle que seuls 4 nourrissons sur 24 (17%) ont atteint une concentration sérique en vitamine K1 supérieure à 10 ng/ml.
Les données d'une étude rétrospective indiquent qu'une prophylaxie orale hebdomadaire s'est montrée efficace dans la prévention de la maladie hémorragique du nouveau-né. Au total, 507 850 nouveau-nés vivants sont nés durant la période de l'étude, de novembre 1992 à juin 2000. Parmi ces nourrissons, respectivement 78% et 22% ont reçu un traitement prophylactique par voie orale et intramusculaire, c'est-à-dire environ 396000 nouveau-nés ont reçu un traitement prophylactique par voie orale à la naissance. Un traitement prophylactique hebdomadaire par voie orale était recommandé pour tous les nourrissons jusqu'à la fin de leur allaitement maternel exclusif : à la naissance 2 mg de phytoménadione, suivis de 1 mg hebdomadaire étaient administrés par voie orale par les parents jusqu'aux 3 mois de l'enfant. Aucun cas de maladie hémorragique du nouveau-né n'a été rapporté : l'incidence était de 0-0,9 /100000 (IC 95%).
5.2. Propriétés pharmacocinétiques 
La vitamine K1 liposoluble est absorbée très rapidement par le tube digestif (presque aussi rapidement par voie orale que par voie parentérale) en présence de sels biliaires, puis stockée dans le foie. Les réserves de l'organisme couvrent les besoins pendant environ 8 jours.
La vitamine K1 ne traverse pas facilement la barrière placentaire et son élimination dans le lait maternel est faible.
La demi-vie d'élimination plasmatique de la vitamine K1 est d'environ 70 h. L'élimination se fait par voie biliaire et urinaire sous forme conjuguée.
5.3. Données de sécurité préclinique 
3 ans.
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 25°C et à l'abri de la lumière.
Utilisez le produit ou la solution diluée immédiatement après la préparation.
6.5. Nature et contenu de l'emballage extérieur 
0,2 ml en ampoule (verre brun de type I) avec pipette (polypropylène). Boîte de 1, 6 ou 30 ampoules,
0,2 ml en ampoule (verre brun de type I) avec 5 pipettes (polypropylène). Boîtes de 5 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d'élimination et de manipulation 
Voie orale : l'administration orale de la solution VITAMINE K1 CHEPLAPHARM 2mg/0,2 ml NOURRISSONS s'effectue à l'aide de la pipette graduée se trouvant dans l'emballage. Les graduations en mg (1 mg et 2 mg) inscrites sur le corps de la pipette permettent de mesurer la quantité de Vitamine K1 à administrer.
Procéder de la façon suivante :
· casser le col de l'ampoule, puis introduire la pipette de manière à ce qu'elle plonge dans la solution,
· afin d'éviter la formation de bulles, aspirer un faible volume de solution en tirant le piston et rejeter le contenu de la pipette dans l'ampoule,
· replonger la pipette dans la solution et tirer à nouveau le piston jusqu'à ce sa position corresponde à la dose à délivrer : collerette blanche du piston sur la graduation 1 mg, ou piston en butée pour 2 mg,
· vider le contenu de la pipette directement dans la bouche.
Voie parentérale : la solution VITAMINE K1 CHEPLAPHARM 2 mg/0,2 ml NOURRISSONS ne doit pas être mélangée à d'autres médications parentérales, mais peut être injectée dans la partie inférieure d'un dispositif pour perfusion. La vitamine K1 peut être administrée sans aucune dilution pour les nouveau-nés pesant 2,5 kg ou plus. Pour les nouveau-nés pesant moins de 2,5 kg, des volumes ajustés de solution diluées à 1/5 OU 1/10 dans du glucose 5% peuvent être administrés (voir Rubrique 4.2 - Tableau 1).
Tout médicament non utilisé (solution ou dilution) ou déchet doit être éliminé immédiatement conformément à la réglementation en vigueur.
7. TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHE 
ZIEGELHOF 24
17489 GREIFSWALD
ALLEMAGNE
8. NUMERO(S) D'AUTORISATION DE MISE SUR LE MARCHE 
· 34009 301 223 0 3 : 0,2 ml en ampoule (verre brun) + pipette (polypropylène), boîte de 1
· 34009 348 646 3 6 : 0,2 ml en ampoule (verre brun) + 5 pipettes (polypropylène), boîte de 5,
· 34009 348 648 6 5 : 0,2 ml en ampoule (verre brun) + pipette (polypropylène), boîte de 6,
· 34009 348 649 2 6 : 0,2 ml en ampoule (verre brun) + pipette (polypropylène), boîte de 30.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L'AUTORISATION 
A compléter ultérieurement par le titulaire
10. DATE DE MISE A JOUR DU TEXTE 
A compléter ultérieurement par le titulaire
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Médicament non soumis à prescription médicale.